学术报告笔记
2024年10月21日下午,广州霍夫曼免疫研究所蔡华和陈笛研究员邀请了法国国家医学科学研究中心的Joao Trindade Marques 教授在广州医科大学番禺校区科技大楼327会议室给我们带来了题为“媒介蚊子中天然抗病毒防御机制的解析”的学术报告。
昆虫传播的人类病原体是全球性问题,尤其是由蚊子传播的病原体;例如,疟原虫通过按蚊传播,以及由伊蚊(Aedes)传播的病毒,如登革热病毒(DENV)、寨卡病毒(ZIKV)和基孔肯雅热病毒(CHIKV)等。
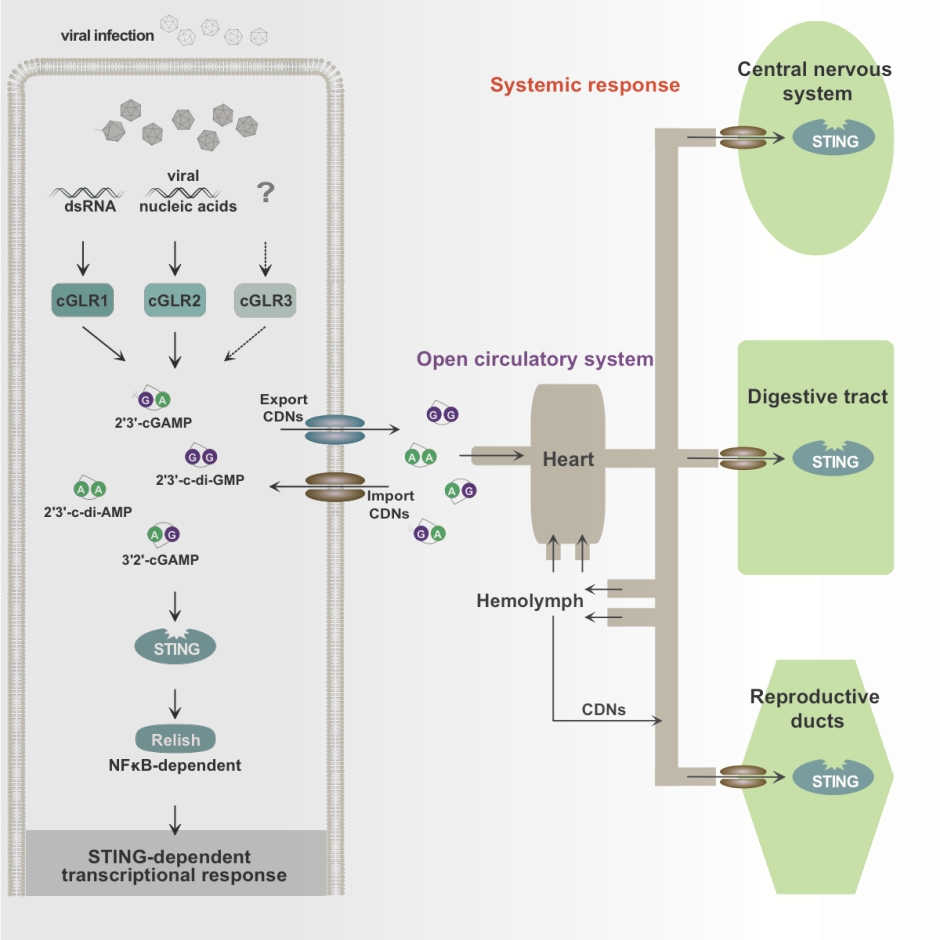
图1:蚊媒病毒带来的危害
登革热病毒(DENV)是一种热带和亚热带地区广泛流行的疾病,世界卫生组织(WHO)估计,每年全球约有3.9亿人次感染登革热病毒,其中有超过2万人因此死亡。登革热不仅是一种重要的公共卫生问题,而且对全球经济、医疗体系和社会造成了显著影响。然而,目前并没有针对登革热病毒的疫苗和特定的治疗方法。
登革热主要通过伊蚊传播,伊蚊通过其吸血行为,将病毒从感染的宿主传播到健康的人群。在自然界中,这些吸血蚊子一旦叮咬了感染者,就会与病毒接触。在外源性潜伏期之后,即蚊子获得病毒和在唾液中有效释放传染性病毒之间的时间后,它们可以在吸食血液时将病毒传播给另一个宿主。蚊子吸血后,病毒会在蚊子体内经过一定的潜伏期(通常为8至12天),并随后通过蚊子的唾液进入人类宿主的血液,从而引发登革热等病毒性疾病的临床症状。这些症状通常包括高热、剧烈头痛、关节和肌肉疼痛、皮疹等,有时还可能导致出血、休克甚至死亡。
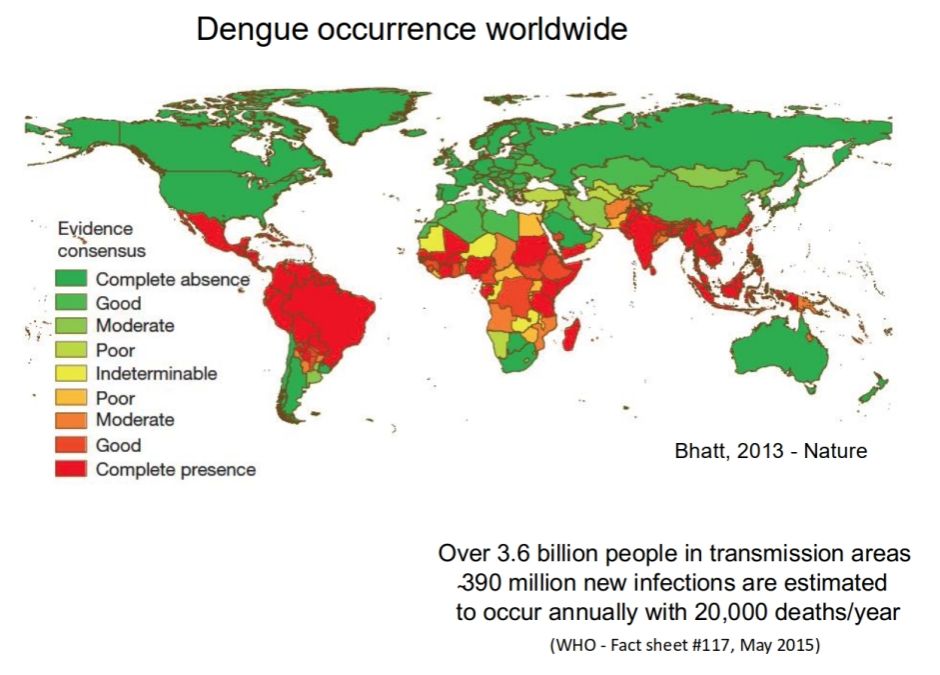
图2:登革热病毒在世界范围内传播
图3:蚊子是登革热病毒传播的重要媒介
登革热病毒的传播已成为全球公共卫生面临的重要挑战,尤其是在热带和亚热带地区。通过加强对伊蚊生物学和病毒传播机制的研究,以及开发更有效的控制和预防措施,减缓或控制这种由蚊媒传播的致命疾病的蔓延,减少其对人类健康的威胁。对此,Joao团队从虫媒病毒的介体入手,了解促成伊蚊获得、复制和传播虫媒病毒的能力的因素,并遏制虫媒病毒的传播。在研究中,他们发现自然界中只有一小部分蚊子被登革病毒感染,相比于流行地区34%的人类感染率,仅有5%的蚊子感染了登革病毒。这是否暗示蚊子存在天然的抗病毒抗性?这能否在实验室中建立模型?
为此Joao团队在实验室建立了口服感染DENV的模型,通过剂量依赖的方式,研究人员发现在从25PFU到2500PFU的情况下,随着病毒量的增加,感染了病毒的蚊子逐渐增加,然而令人惊讶的是再提高十倍剂量的病毒,被感染的蚊子的数量并没有更多,与2500PFU的病毒相比没有差异。说明蚊子对于DENV确实具有一定的抵抗(Resistant)。
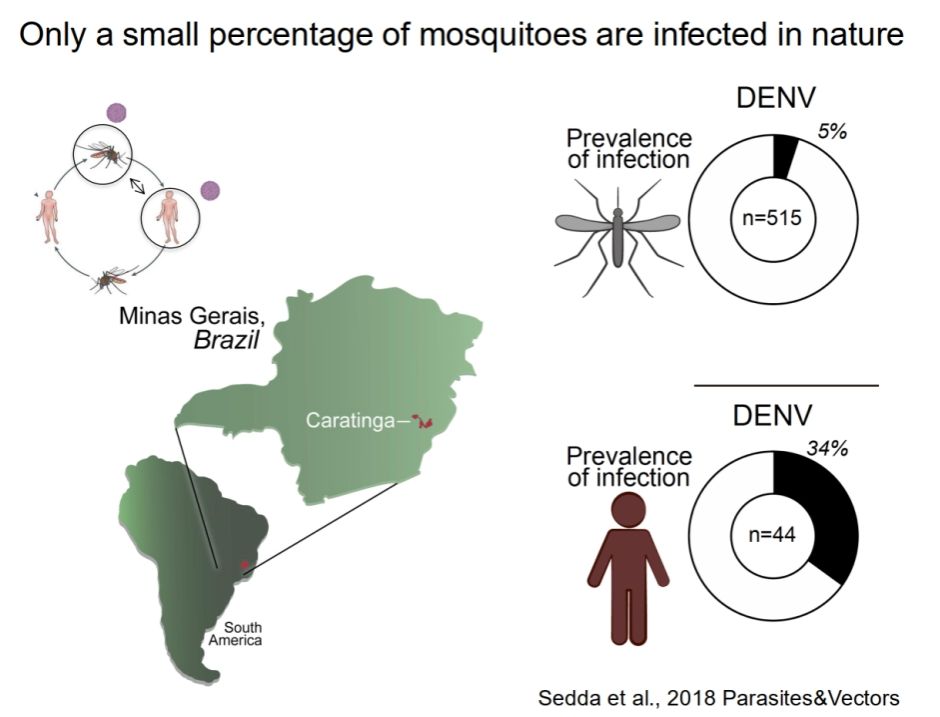
图4:自然状况下只有小部分蚊子感染了登革热病毒
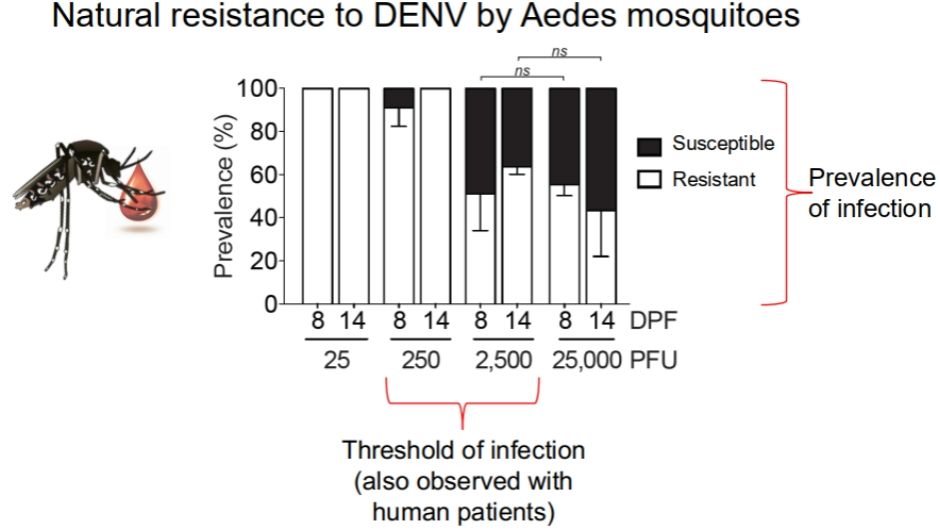
图5:埃及伊蚊对登革热病毒具有天然的抗性
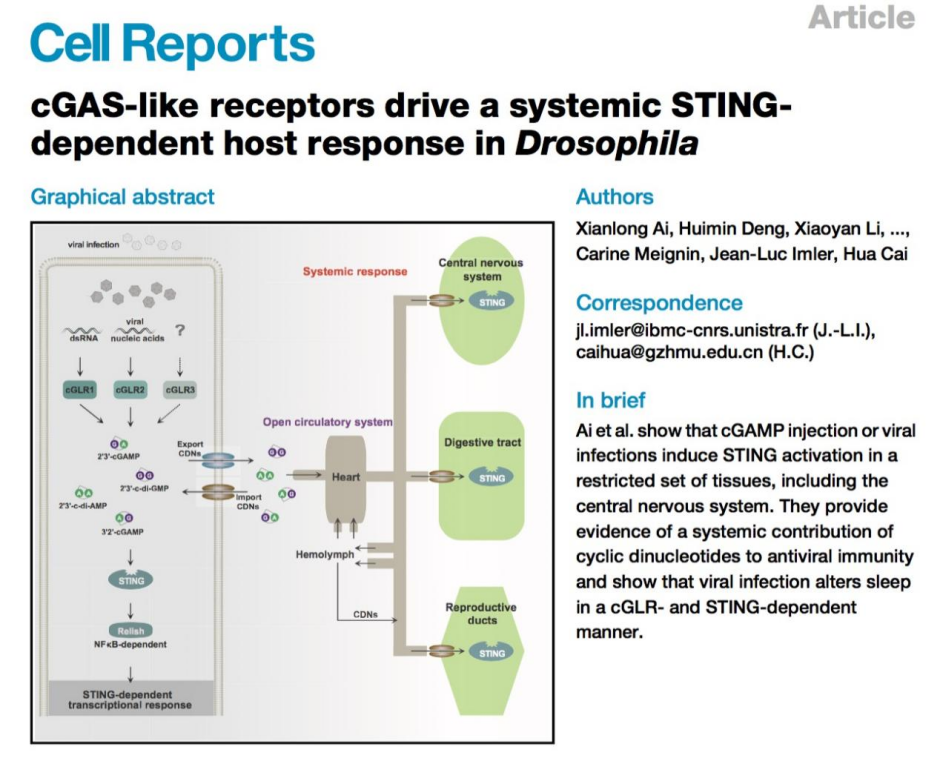
在思考这种现象发生机制的时候,我们一般认识这种抗病毒的表型更多的与免疫反应联系在一起。动物中的抗病毒反应,一般认为其主要由RANi和诱导性的信号转导反应发挥主要的抗病毒反应。根据之前的文章报道抗病毒免疫机制在动物界的分布比传统观点更为复杂。转录反应似乎是大多数动物抗病毒免疫的一个关键特征,但在无脊椎动物中的研究尚不充分。在刺胞动物和软体动物中,实验发现病毒感染会引发基因的转录反应,且这些基因与哺乳动物的免疫防御基因(ISGs)具有同源性。然而,在常见的无脊椎动物模式生物——如线虫和果蝇中,并没有发现与经典的ISGs和IRFs(干扰素调节因子)同源的基因,意味着它们缺乏类似哺乳动物的干扰素反应。但是果蝇也会在病毒感染后发生基因表达变化,这种反应通过经典的先天免疫受体通过识别病毒核酸所触发,尽管它们不依赖于IRFs,也不包括与ISGs同源的基因。因此,从信号转导上,他们团队通过生信分析发现在蚊子当中可能并不存在我们所认为在无脊椎动物当中发挥主要抗病毒信号转导的通路的组分STING和cGLRs的同源基因。
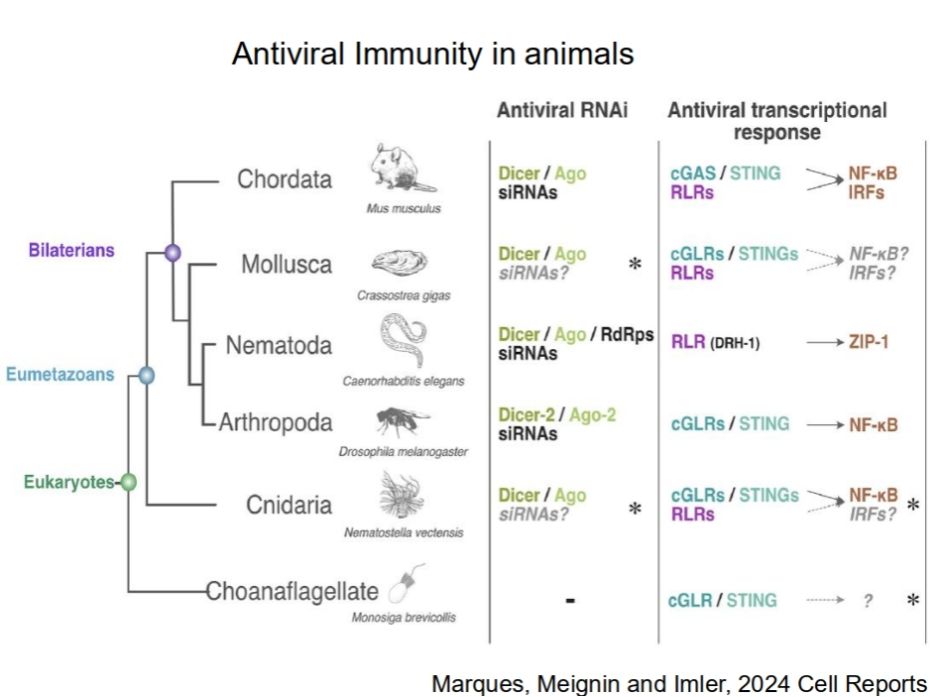
图6:动物中介导抗病毒转录反应和RNA干扰的途径的作用
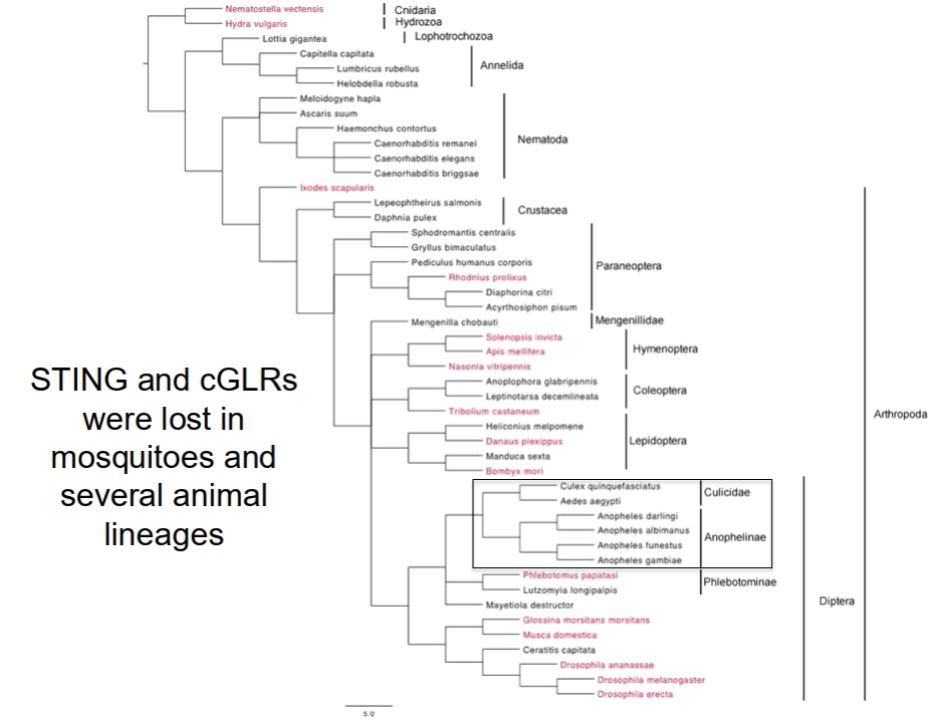
图7:蚊子当中目前并没有发现STNG和cGLRs的同源基因
因此,在蚊子当中,这种现象的发生可能主要由RNAi来介导。RNA干扰通过产生小干扰RNA(siRNA)来发挥作用,这些siRNA在细胞内通过识别并降解病毒RNA,限制病毒的复制。具体来说,当昆虫受到病毒感染时,病毒的双链RNA(dsRNA)成为RNAi途径的启动信号。病毒衍生的dsRNA通过细胞内的Dicer酶被切割成小片段,形成特定的siRNA。随后,这些siRNA与RNA诱导沉默复合体(RISC)结合,指导该复合体识别并降解与之完全互补的病毒RNA,从而有效抑制病毒的复制和扩散。病毒衍生的siRNA的产生是RNA干扰反应的标志,它不仅是昆虫抗病毒免疫反应中的关键步骤,也是其特异性识别和靶向病毒基因组的重要机制。该过程的效率和特异性通常依赖于昆虫的免疫系统对病毒感染的感知能力,以及细胞内RNAi相关蛋白的功能。
所以,为了确定 RNAi是否有助于清除/控制病毒,他们对三组蚊子在不同时间点的小 RNA 进行了深度测序。发现仅在病毒载量高的个体中观察到 DENV 衍生 siRNAs 的产生(21nt累积,在有义和反义链之间对称分布)。这些蚊子产生的病毒源 siRNA 随时间增加,并与病毒载量相关。在低病毒载量个体的整个感染动力学过程中,检测到几十个百万读数(RPM)的病毒衍生小 RNA,但这些小 RNA 的大小分布很广,表明是随机降解产物。未检测到病毒载量组的蚊子的病毒衍生siRNA背景量与未感染对照组相似,小于10RPM。所以,在这些蚊子中,siRNA途径可能并不负责消除或控制DENV。
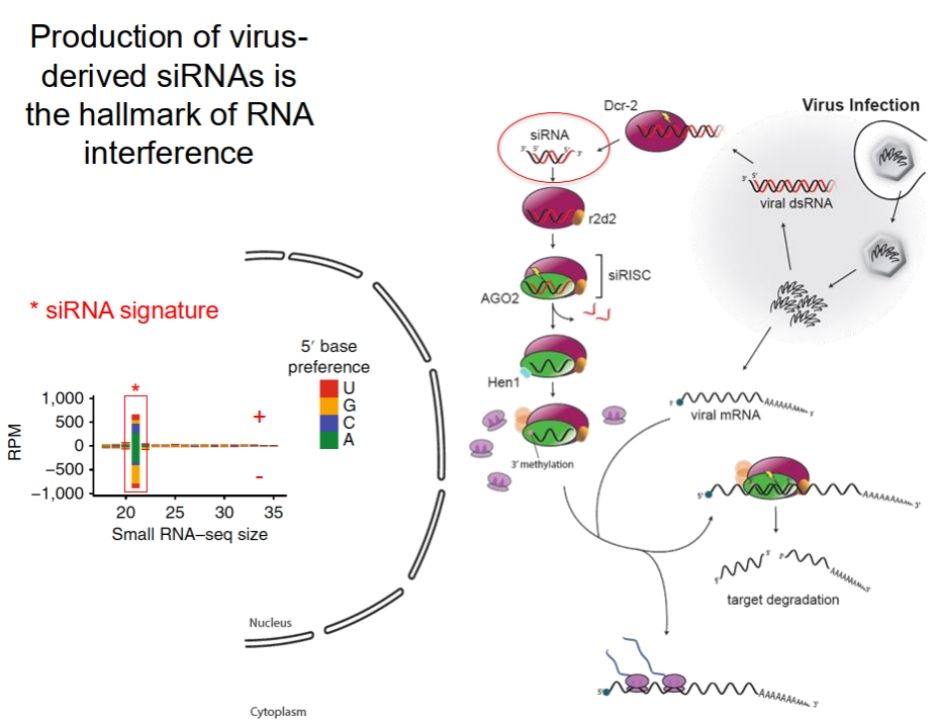
图8:RNA干扰途径是昆虫抗病毒免疫的一种有效机制,病毒衍生siRNA的产生是RNA干扰的标志

图8:在受感染的蚊子中生产源自DENV的siRNAs
接下来,他们通过沉默siRNA诱导的沉默复合物的核心成分AGO2,评估了蚊子RNAi对DENV感染不同输出的影响。与靶向萤火虫荧光素酶基因(dsFLUC)的对照相比,注射与AGO2互补的dsRNA(dsAGO2)可导致中肠中该基因85.7%的沉默。尽管沉默效果很好,但经dsAGO2处理的蚊子在3和4d.p.f.时,中肠中的病毒载量和感染率并没有增加。为了直接监测病毒在中肠中的复制,他们用识别病毒包膜蛋白的抗体进行免疫荧光显微镜观察。定量成像结果显示,与对照组相比,经dsAGO2处理的蚊子每个中肠的DENV感染灶数量没有增加,甚至略有减少。此外,dsAGO2和对照组蚊子感染灶的大小也没有差异。这些结果证实了siRNA途径对控制早期 DENV 感染或蚊子中肠复制的影响有限。


图9:siRNA途径不控制中肠感染
然后他们分析了被传染性血餐感染的蚊子的尸体。在3和4d.p.f.对照蚊子和经dsAGO2处理的蚊子尸体中的病毒载量没有显著差异。对照组蚊子和经dsAGO2 处理的蚊子也几乎没有表现出 DENV的系统性传播,尸体中的低感染率也说明了这一点。相比之下,dsAGO2处理的蚊子在8 d.p.f.的传播感染率明显较高,尽管病毒RNA水平在这个时间点没有明显增加。这些结果表明,抗病毒 siRNA 途径不能控制蚊子中肠中的 DENV 感染,但能抑制系统性传播和复制。
图10:siRNA通路限制DENV传播
通过上述实验,抗病毒机制并不是野生蚊子对病毒产生天然抗性的原因。利用其它实验室已有的蚊子进行监测发现,不同地域的伊蚊自然种群的自然抗性也各不相同。接下他们通过遗传学,生物信息,以及各类的高通量测序和相关的实验验证发现DENV易感性与更活跃的呼吸谱相关,相关工作正在进行中。

图11:伊蚊自然种群的自然抗性各不相同
Joao Marques教授为我们介绍的伊蚊如何识别和对抗病毒感染开阔了我们的视野,使我们受益颇多。在这里,再次感谢Joao Trindade Marques教授的精彩报告!
参考文献:
1. Olmo RP, Ferreira AGA, Izidoro-Toledo TC, Aguiar ERGR, de Faria IJS, de Souza KPR, Osório KP, Kuhn L, Hammann P, de Andrade EG, Todjro YM, Rocha MN, Leite THJF, Amadou SCG, Armache JN, Paro S, de Oliveira CD, Carvalho FD, Moreira LA, Marois E, Imler JL, Marques JT. Control of dengue virus in the midgut of Aedes aegypti by ectopic expression of the dsRNA-binding protein Loqs2. Nat Microbiol. 2018 Dec;3(12):1385-1393.
2. Olmo RP, Todjro YMH, Aguiar ERGR, de Almeida JPP, Ferreira FV, Armache JN, de Faria IJS, Ferreira AGA, Amadou SCG, Silva ATS, de Souza KPR, Vilela APP, Babarit A, Tan CH, Diallo M, Gaye A, Paupy C, Obame-Nkoghe J, Visser TM, Koenraadt CJM, Wongsokarijo MA, Cruz ALC, Prieto MT, Parra MCP, Nogueira ML, Avelino-Silva V, Mota RN, Borges MAZ, Drumond BP, Kroon EG, Recker M, Sedda L, Marois E, Imler JL, Marques JT. Mosquito vector competence for dengue is modulated by insect-specific viruses. Nat Microbiol. 2023 Jan;8(1):135-149.
3. Marques JT, Meignin C, Imler JL. An evolutionary perspective to innate antiviral immunity in animals. Cell Rep. 2024 Sep 24;43(9):114678.
4. Shaw WR, Catteruccia F. Vector biology meets disease control: using basic research to fight vector-borne diseases. Nat Microbiol. 2019 Jan;4(1):20-34.
【报告人】Joao Trindade Marques教授
【撰稿人】魏子明、陈裕强
【校稿人】蔡华、陈笛
【策 划】广州霍夫曼免疫研究所研究生会学术部