广州霍夫曼免疫研究所Jean Luc Imler/蔡华团队发现果蝇cGLR-STING驱动系统性宿主反应
病毒感染对所有生命有机体构成无处不在的威胁。研究并利用生物体抗病毒策略的多样性对防控人类社会关注的病毒性传染病至关重要。天然免疫是所有生命有机体控制病毒感染的第一道防线。尽管病毒种类多样,病毒进入细胞后主要被机体天然免疫识别的是病毒核酸。在果蝇中,业界很长一段时间认为RNA干扰是唯一识别病毒核酸的广谱抗病毒免疫机制。直到2021,Imler/蔡华团队和美国哈佛医学院Philip J. Kranzusch以及丹麦Aarhus University的Rune Hartmann教授,发现黑腹果蝇中两个与cGAS相关的受体,命名为cGLR1和cGLR2。cGLR1识别病毒核酸,产生环状二核苷酸(cyclic dinucleotide,CDN)3'2'-cGAMP激活STING依赖的抗病毒免疫(Nature,2021a;Nature,2021b)。该研究首次揭示了昆虫识别病毒核酸触发抗病毒免疫信号转导的分子机制(Nature同期发表Nature views & News;Trend in Immunology和STTT发表评述)。此后Imler/蔡华团队与Kranzusch教授继续合作,研究进化上跨越了5000万年14种不同种属果蝇中由CDN引发的免疫反应,鉴定发现目前最强的果蝇STING激动剂,新型环状二核苷酸2'3'-cdi-GMP(Immunity,2023,Immunity同期发表Preview)。
既然cGLR-STING和RNA干扰这两种抗病毒机制都可以识别病毒的dsRNA,那为什么果蝇体内要同时存在两种识别病毒dsRNA的机制?围绕上述问题,Imler/蔡华团队发现了病毒感染果蝇可以激活非感染细胞以及远端组织中的STING信号通路,脂肪体特异性表达cGLR2可以抑制肠道病毒Nora的感染。此外,STING信号的系统性激活不仅可以通过交配从雄性果蝇传递到雌性果蝇,还可以影响包括睡眠在内的多种昆虫生理过程。
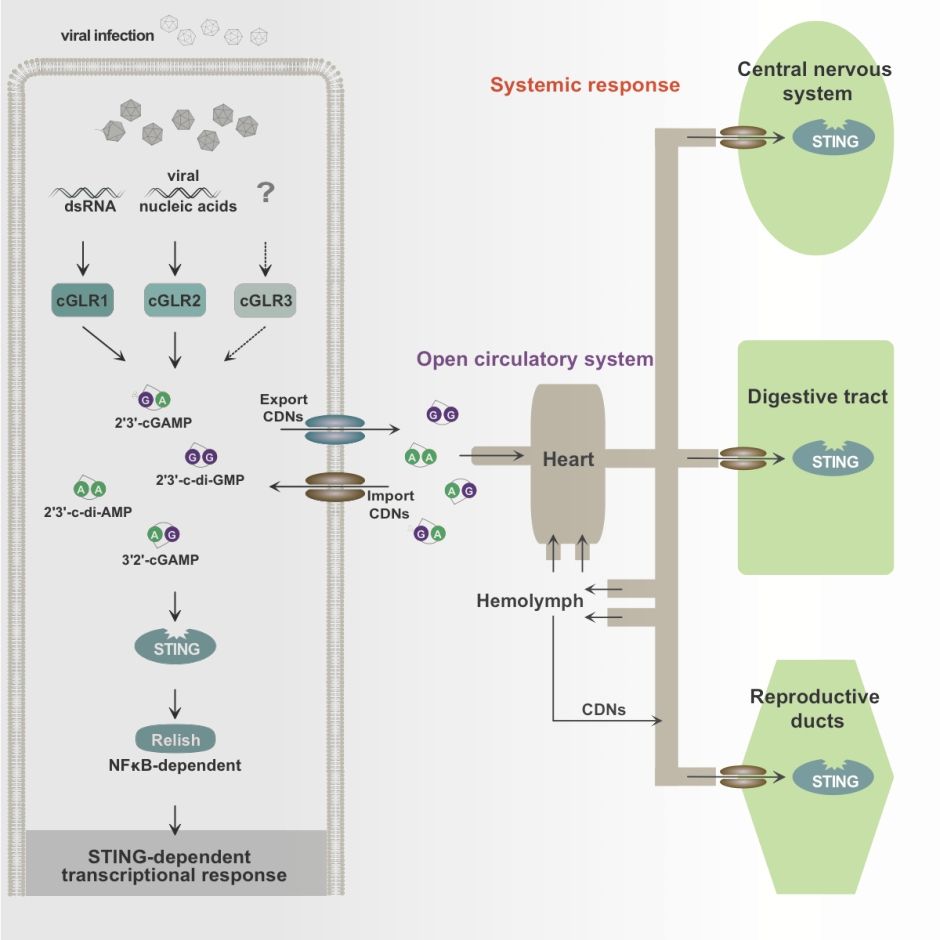
具体而言,该团队在STING终止密码子前敲入编码eGFP的基因序列,得到STING-GFP报告果蝇,从而可以在果蝇体内跟踪STING通路的激活情况。他们发现注射环状二核苷酸 3′2′-cGAMP后,STING信号在四种组织中被激活,包括:中枢神经系统、中肠、马氏管和生殖管。然后比较了注射 3′2′-cGAMP 和感染了两种不同病毒的果蝇,发现STING::GFP 在不同组织中的诱导模式相同,提示病毒感染可以系统性激活果蝇体内的STING信号。之后他们发现脂肪体中过表达cGLR2 可以诱导远端组织中的 STING 信号,并且可以抵抗肠道病毒Nora的感染。令人惊讶的是,果蝇病毒DCV和Nora感染激活的系统性STING 信号可以在交配过程中从雄性果蝇以 cGLR1/2 依赖的方式传递到雌性果蝇。不仅如此,DCV感染会以cGLR1/2 和 STING 依赖的方式改变果蝇睡眠行为。总之,这些研究结果提示cGLR通过识别局部病毒感染,诱导环状二核苷酸生成并在血淋巴中循环,调动果蝇系统性的抗病毒免疫反应。这种由环状二核苷酸介导的系统性抗病毒免疫,可能是昆虫除了RNA干扰,还存在识别dsRNA的cGLR-STING通路的重要原因。而STING通路对睡眠等生理功能的调控,提示应对感染时触发的免疫系统,还具有调节其他生理功能的作用。
广州医科大学霍夫曼免疫研究所为论文第一完成单位。第一作者包括艾贤龙博士后,硕士研究生邓慧敏和李晓妍。论文通讯作者包括蔡华研究员(Lead contact)和Jean-Luc Imler教授。该研究得到国家重点研发计划政府间合作项目,国家级项目,国家自然科学基金,广东省杰出青年基金和中国博士后科学基金等资助。