表观遗传学是生命科学的重要分支,聚焦于DNA序列不变情况下基因功能可逆且可遗传的变化机制。多梳蛋白复合体(Polycomb group, PcG)是表观遗传调控的重要因子,通过介导组蛋白修饰和染色质三维结构重塑,在转录水平调控靶基因表达,参与胚胎发育、干细胞维持、基因组印记及癌症发生等关键生物学过程。PcG复合体需在细胞核内发挥作用,但其核心组分的入核机制此前尚不明确。
2025年12月13日,Journal of Genetics and Genomics在线发表广州医科大学霍夫曼免疫研究所焦仁杰团队和北京大学生命科学学院朱健/刘敏团队合作题为“A non-canonical bipartite NLS dictates nuclear import and function of the Drosophila Pc protein”的研究论文。该研究揭示了PcG核心组分Pc蛋白通过一个非经典双元核定位序列(bipartite nuclear localization signal, NLS)入核,NLS突变会引发Pc蛋白的胞质滞留及同源异型转变等发育缺陷。
该研究在探究Pc蛋白泛素化修饰功能时,意外发现潜在泛素化位点突变引起Pc蛋白完全核外定位。后续实验证实,该异常定位与泛素化修饰无关,而是源于NLS的破坏。通过突变体和GFP报告基因实验,该研究成功鉴定出Pc蛋白的双元NLS,其linker区域长达37个氨基酸,属于非经典类型。NLS突变的果蝇品系纯合致死,杂合子则呈现典型同源异型转变表型。机制研究表明,Pc蛋白通过双元NLS与Importin α1特异性结合;敲低importin α1后,Pc蛋白胞质滞留,证实Importin α1介导了Pc的核导入。
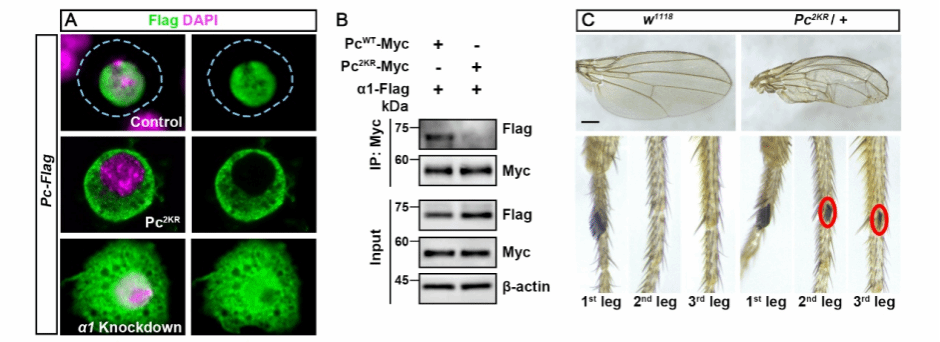
Pc通过核定位信号序列结合Importin α1入核发挥生理功能
A: 核定位序列突变和importin α1敲低导致Pc亚细胞定位异常。B:Pc与Importin α1存在相互作用,而核定位序列突变破坏了两者的相互作用。C:Pc核定位序列的突变导致杂合子果蝇出现同源异形转变的表型。
综上所述,该研究阐明了Pc蛋白的入核机制及其生理功能,为深入理解PcG复合体的工作模式提供了重要补充。
广州医科大学霍夫曼免疫研究所为第一完成单位。广州医科大学霍夫曼免疫研究所焦仁杰团队何涛博士和北京大学生命科学学院范昱博士为该论文共同第一作者,北京大学生命科学学院朱健教授和刘敏副研究员为该论文的共同通讯作者。该研究得到了科技部重点研发计划、国家自然科学基金、膜生物学全国重点实验室、北大-清华生命科学联合中心和北京大学博雅博士后基金的资助。
引用本文:Tao He, Yu Fan, Yongchang Zeng, Jie Zhou, Renjie Jiao, Alan Jian Zhu, Min Liu. (2025). A non-canonical bipartite NLS dictates nuclear import and function of the Drosophila Pc protein. Journal of Genetics and Genomics.
DOI: 10.1016/j.jgg.2025.05.007